Xử phạt 2 công ty dược vì sản xuất thuốc vi phạm chất lượng
(CHG) Cục Quản lý Dược (Bộ Y tế) vừa ra quyết định xử phạt hành chính đồng thời buộc tiêu hủy toàn bộ 2 lô thuốc vi phạm chất lượng mức độ 2 của Công ty cổ phần Dược Hà Tĩnh và Công ty cổ phần 23 tháng 9.
Theo quyết định số 746/QĐ-XPHC ngày 16/11/2022 của Cục Quản Lý Dược, Công ty cổ phần Dược Hà Tĩnh (trụ sở chính: TP. Hà Tĩnh, tỉnh Hà Tĩnh) đã sản xuất thuốc Nutrohadi F, số giấy đăng ký lưu hành VD-18684-13, số lô 030221, NSX 24/2/2021, HSD 23/2/2024 vi phạm chất lượng mức độ 2 theo quy định của pháp luật. Với sai phạm trên, Công ty cổ phần Dược Hà Tĩnh bị xử phạt hành chính 70 triệu đồng, buộc tiêu hủy lô thuốc Nutrohadi F không đảm bảo chất lượng.
Với Công ty cổ phần 23 tháng 9 (trụ sở chính: quận 6, TP. Hồ Chí Minh), Cục Quản lý dược chỉ rõ quá trình sản xuất thuốc Batiwell, số giấy đăng ký lưu hành VD-31011-18, số lô 00121, NSX 8/3/2021, HSD 8/3/2024 vi phạm chất lượng mức độ 2 theo quy định của pháp luật. Ngày 16/11/2022, Bộ Y tế đã ra quyết định số 745/QĐ-XPHC xử phạt hành chính Công ty cổ phần 23 tháng 9 số tiền 70 triệu đồng và buộc tiêu hủy lô thuốc vi phạm nêu trên.
Với Công ty cổ phần 23 tháng 9 (trụ sở chính: quận 6, TP. Hồ Chí Minh), Cục Quản lý dược chỉ rõ quá trình sản xuất thuốc Batiwell, số giấy đăng ký lưu hành VD-31011-18, số lô 00121, NSX 8/3/2021, HSD 8/3/2024 vi phạm chất lượng mức độ 2 theo quy định của pháp luật. Ngày 16/11/2022, Bộ Y tế đã ra quyết định số 745/QĐ-XPHC xử phạt hành chính Công ty cổ phần 23 tháng 9 số tiền 70 triệu đồng và buộc tiêu hủy lô thuốc vi phạm nêu trên.
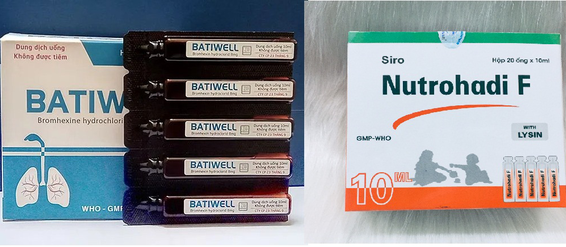
Hai lô thuốc vi phạm chất lượng bị thu hồi.
Trước đó, Cục Quản lý dược cũng đã có văn bản xử phạt hành chính đối với Công ty cổ phần y học Rạng Đông (ngày 14/11) và Công ty Genome Pharmaceutical (Pvt) Ltd (Pakistan) (ngày 11/11) tổng số tiền hơn 200 triệu đồng. Đồng thời buộc tiêu hủy lô thuốc 75 lọ (lọ 10 ml) chất đánh dấu từ nguyên liệu 180 Water, số lô 190408004-3 đã hết hạn sử dụng và thuốc viên nén Neometin, số giấy đăng ký lưu hành VN-17936-14, số lô 074, NSX 07/2020, HD 07/2022 do 2 công ty này sản xuất vì vi phạm chất lượng mức độ 2 theo quy định của pháp luật
